在6月1日举行的2015年ASCO年会的新闻发布会上,宣布了两项临床研究计划,即ASCO的TAPUR研究(Targeted Agent and Profiling Utilization Registry)和国立癌症研究所的NCI-MATCH研究(Molecular Analysis for Therapy Choice trial (EAY131))。这两项即将进行的临床研究将致力于扩展精准医学的范围。依据NCI副主任、医学博士James H. Doroshow的说法,其中的NCI-MATCH研究是“史上最大的,最严谨的精准医学研究”。

Dr. Clifford A. Hudis
许多医师经常会面临如何利用基因检测的结果来帮助患者这个问题。在这种情况下,即将开展的这2项研究就显得非常重要。正如大会主持人,来自Memorial Sloan Kettering癌症中心的Clifford A. Hudis(医学博士,美国内科医师协会会员)所说,“我们在这方面存在巨大的知识空缺,但同时我们也面临着惊人的机遇”。
TAPUR研究
TAPUR是一项前瞻性,非随机的临床研究。其计划采集信息以评价目前已经上市的靶向药物对于存在基因突变靶点的肿瘤(包括晚期实体肿瘤、多发性骨髓瘤、B细胞非霍奇金淋巴瘤)的有效性和毒性。项目启动后,TAPUR计划评价来自5家制药企业的10-15种药物。而患者会依据肿瘤类型、基因变异和使用药物纳入不同的队列,每个队列不超过24人。患者招募预计将在今年年底前开始。
首先要基于宽松的入选/排除标准对患者进行筛查,以明确他们的健康状况是否符合这一研究要求。如果患者符合试验标准,那么经治医师会从TAPUR研究方案备选的药物中选择一种针对患者肿瘤基因突变的药物。如果研究方案中无明确阐述的匹配药物,医师会咨询分子肿瘤委员会(Molecular Tumor Board)。委员会会进一步评估患者的临床和遗传特点,来建议是否纳入或剔除治疗药物。
TAPUR研究的主要终点是客观缓解(依据RECIST)。其它研究终点包括无进展生存期、总生存期、治疗持续时间和治疗相关严重不良事件。

Dr. Richard L. Schilsky
依据ASCO首席医疗官Richard L. Schilsky(MD, FASCO)的说法,TAPUR会利用日常肿瘤治疗实践中已经在使用的分子靶向和可能的治疗方案的信息。由于缺少有效途径了解患者超说明书用药使用靶向药物的经验,现阶段这一信息未得到利用。
接下来,机构审查委员会会评估研究计划和知情同意书。ASCO设立了3个监督委员会,委员包括患者代表、临床肿瘤医师、统计学家和基因组学专家。
首先是筹划指导委员会,其监督计划运行、制定数据共享和出版政策、评估增减药物方案、审批临床研究基地。
其次是分子肿瘤委员会,其评估药物与治疗疾病是否匹配,并建议将药物纳入/剔除该研究。
此外,设立数据和安全监测委员会,其定期评估研究结果将保证严重和意外不良事件得到严密监测,确定各队列的扩展或停止,决定何时公布数据以及公布对象。
ASCO会赞助并组织该研究的运作事宜,包括协调多方合作,如患者、医师、ASCO监督委员会、制药公司、技术公司、社区研究基地。TAPUR会在密歇根癌症研究联盟、密歇根西部癌症研究联盟和卡罗莱纳州医疗系统等研究基地启动,且计划扩展到全国。ASCO还将与荷兰个体化癌症治疗中心(Netherlands Center for Personalized Cancer Treatment)合作并共享数据。该中心在进行的临床研究与TAPUR研究计划非常相似。
NCI-MATCH研究
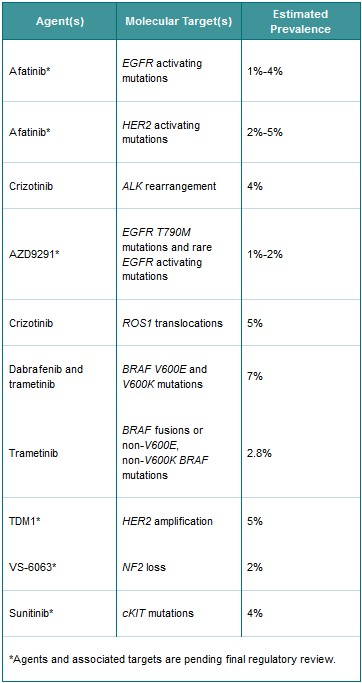
NCI-MATCH研究II期将会包括20种以上不同的药物或药物组合。每种药物或组合均针对某种特定的基因突变,而研究中每名患者会接受针对其分子突变的治疗。启动时计划开展10个子研究(见表1),在数月内增至20个或更多。患者招募从2015年7月开始。
Table 1. Initial Substudies Planned in NCI-MATCH
患者纳入后首先进行筛选。包括肿瘤样本活检和基因测序,检测有无驱动肿瘤生长且符合研究药物作用靶点的基因突变。如果患者的基因突变符合某项子研究条件,那么进一步评价该患者是否符合该子研究入选标准。若符合并纳入,只有患者肿瘤缩小或保持稳定,患者将持续使用子研究组靶向药物治疗。研究者们计划研究期间筛查至少3000名患者,目标总共纳入1000名左右患者(每个子研究组不超过35人)。研究需要至少1/4的患者患有罕见肿瘤(除非小细胞肺癌、前列腺癌、乳腺癌、结肠癌外)。
研究对象需要年满18周岁,患有进展期实体瘤或淋巴瘤,且接受过至少一次标准全身治疗或该肿瘤无标准治疗。
该研究有2个研究终点:客观缓解率(ORR,主要终点)和6月无进展生存。在接受靶向治疗子研究组中,客观缓解率在16-25%和6月无进展生存率达到35%或以上被认为前景良好。
该研究联合主席Barbara A. Conley(MD,NCI)称该研究需要高度协作。
该研究由NCI和ECOG-ACRIN癌症研究组共同开发,属于NCI资助的国家临床试验研究网络(NCTN)的一部分。该研究由ECOG-ACRIN牵头。领导各子研究的主要研究人员遍布NCTN和其合作伙伴:ECOG-ACRIN, the Alliance for Clinical Trials in Oncology, NRG Oncology和SWOG。患者权益团体参与了这一研究的开发并帮助监督研究计划和其他方面。