Current and future therapies for hepatitis C virus infection.
N Engl J Med 2013 May 16;368(20):1907-17
T·杰克·梁(Liang)等
美国马里兰州贝塞斯达市国立卫生研究院糖尿病、消化和肾脏疾病研究所肝脏疾病分部等
慢性丙型肝炎病毒(HCV)感染造成相当大的疾病负担。目前,仅仅在发现HCV之后的20年内,不仅在美国而且在世界各地,都有了适合于大多数慢性感染者的治愈方法。最近,两种可特异性地抑制病毒复制的直接作用抗病毒药物获得了批准,这两种药物极大地提高了病毒的清除率,即从最初应用干扰素单药治疗的不足10%,提高至应用目前疗法的70%以上。此外,许多其他针对病毒或宿主因素的药物也处于研发中,在未来几年内,一些将几乎肯定会获得批准。解决哪些患者应接受治疗和采用什么方案进行治疗的问题将越来越复杂,需要(我们)深思熟虑。随着治疗手段的进步,对需要治疗的患者进行全方位辨别和治疗将是下一个挑战。由于大多数被感染者并不知道他们的诊断,(美国)疾病预防和控制中心已于最近建议对所有在1945-1965年期间的出生者进行HCV筛查。在这样的筛查过程中,预期将有大量人群被发现感染了该病毒,关于是否可能对所有这些感染者给予治疗,目前尚不清楚。本文综述了HCV感染的当前疗法和药物开发的前景。
HCV感染治疗的作用机制
在过去的20年内,针对病毒生命周期分子通路的基础研究已成为带动HCV感染治疗(药物)研发的引擎。HCV是一种正链RNA病毒,编码一种多聚蛋白,可被蛋白水解(酶)裂解为10种多肽,每种都有其独特的功能(图 1)。(病毒)结构蛋白质由两种包膜糖蛋白和核心蛋白构成,两种包膜糖蛋白都是宿主抗体应答反应的靶点,而核心蛋白质可与装配病毒的子代病毒基因组相互作用。(病毒的)非结构蛋白质NS2、NS3、NS4A、NS4B、NS5A和NS5B与病毒RNA形成一个复合物,在一个细胞质膜性结构中启动病毒的复制。HCV装配需要与脂滴和脂蛋白代谢间的紧密相互作用9,成熟的病毒以脂病毒颗粒的形式从细胞内释放出来。HCV主要感染肝细胞,并且具有一种神秘的、可以多种方式逃避宿主免疫应答反应的能力。
干扰素α是一种有效的HCV复制抑制剂,通过诱导具有抗病毒功能的干扰素-刺激性宿主基因而发挥作用,它的聚乙二醇化形式目前仍是HCV治疗的支柱。由于干扰素α对HCV有各种不同的作用,因而它与病毒耐药无关。慢性HCV感染可通过干扰宿主的干扰素应答和干扰素-刺激性基因的表达,使其在肝脏内对外源性干扰素α产生抵抗,继而可引起干扰素α的临床无应答。利巴韦林是治疗方案的一个关键组成成分,它可与干扰素α产生协同作用,被联合应用于HCV感染的治疗,利巴韦林可能也具有多种作用机制。
在治疗HCV感染的抗病毒药物的研发方面,HCV感染的小分子抑制剂已成为近期研究的焦点(图 1)。可以根据作用靶点的不同对它们进行分类,一些抗病毒药物直接作用于病毒靶点,而其他一些药物的靶点是对HCV复制至关重要的宿主蛋白。最初的研究集中在病毒-编码的两种酶(可裂解HCV多聚蛋白的NS3/4A丝氨酸蛋白酶以及NS5B RNA依赖性RNA聚合酶)上。特拉泼维(telaprevir)和博赛泼维(boceprevir)是两种最早获批的直接作用的抗病毒药物,它们均是NS3/4A蛋白酶的抑制剂。NS5A病毒蛋白是另一种靶点,它在装配细胞质膜-结合的复制复合物中具有重要意义,体外研究以及在人体中进行的研究均显示出NS5A病毒蛋白抑制剂具有强大的作用,该靶点最近也已吸引了人们的关注。人们正在将其他病毒蛋白如核心蛋白(在病毒装配中发挥作用)、p7(形成与病毒装配有关的离子通道)和NS4B(在复制复合体的形成中发挥作用)作为药物的靶点进行探讨(图 1)。
图 1 丙型肝炎病毒(HCV)的生命周期和(抗病毒)治疗靶点
HCV在一个肝细胞内增殖的连续步骤如图A所示。病毒和脂蛋白形成复合物,在血液中循环。HCV进入因子包括清道夫受体B1(SCARB1)、CD81、密封蛋白1(CLDN1)、闭合蛋白、表皮生长因子受体(EGFR)以及尼曼-皮克C1样蛋白质1(NPC1L1)4。图B显示在内质网膜上拓扑陈列的病毒-编码基因产物,以及已进后期阶段临床研发中重点药物的主要病毒和宿主靶点。HCV生命周期中的其他靶点[如病毒白质p7和NS4B(图B)]以及宿主靶点[包括HCV进入因子、脂类代谢和复制所涉及的膜信通路(图A)]也成为HCV治疗研发的靶点。针对一些进入因子的抑制剂已被研发用于其他的,目前正在对其用于HCV感染的治疗进行验证5-7。符号(+)和(-)分别代表基因组中链和负链,CypA代表环孢素A,E代表包膜糖蛋白,GAG代表糖胺聚糖,LDLR代表低密度蛋白受体,NI代表核苷类似物抑制剂,NNI代表非核苷类似物,NS代表非结构性蛋白质。
有前景的宿主靶点包括亲环蛋白A和miR122。亲环蛋白A是病毒复制复合物中的一种重要组分。而环孢素A则是一种亲环蛋白A的抑制剂,细胞培养研究表明它是一种HCV复制的强效抑制剂,人们正在临床试验中对它的衍生物(如不具备免疫抑制性能的alisporivir、NIM811和SCY-635)进行验证20。MiR122是一种在肝内大量表达、并通过与病毒RNA结合来促进复制的微RNA。一种miR1核酸的抑制剂(miravirsen)在黑猩猩模型中可强效抑制HCV的复制。进入因子是其他的潜在宿主靶点,这些因子的抑制剂可阻止HCV进入细胞内(图 1)。病毒进入抑制剂对接受肝移植患者的治疗尤其重要,因为HCV感染的患者在移植后总是不可避免地发生再感染。移植后的丙型肝炎仍是管理和治疗的一个重要挑战。
基因1型HCV感染的治疗
当前的标准治疗
慢性丙型肝炎的治疗目标是清除病毒,从而可限制或防止并发症的发生,成功治疗的终点是持续病毒学应答,定义为已停止治疗后的24周时,血清中检测不到HCV RNA。该终点可预测病毒的长期清除,并且与症状以及负面临床转归发生率的降低相关。无论哪种病毒株(基因型1、2、3、4、5或6),聚乙二醇干扰素和利巴韦林联合应用均已成为慢性丙型肝炎患者的标准治疗。应用这一方案,基因2或3型HCV感染患者可获得70%~80%的持续病毒学应答率,其他任何基因型的患者可获得45%~70%的持续病毒学应答率。
博赛泼维和特拉泼维的获批使得HCV基因1型感染的治疗有了三联疗法,即将这两种蛋白酶抑制剂的其中一种与聚乙二醇干扰素和利巴韦林联合应用。这两种三联疗法方案的应答率相似,但在给药时机方面却差异很大(应何时用药以及应用多长时间)(图 2)。博赛泼维或特拉泼维都不能单独应用或者减小剂量,因为这可导致耐药株的快速出现。同样,也不能用一种药物替代另外一种药物,因为它们的治疗计划迥然不同,而耐药突变相似。它们未被批准用于除了基因1型以外的其他基因型HCV感染患者。聚乙二醇干扰素α-2a或聚乙二醇干扰素α-2b都可被用于该方案中。
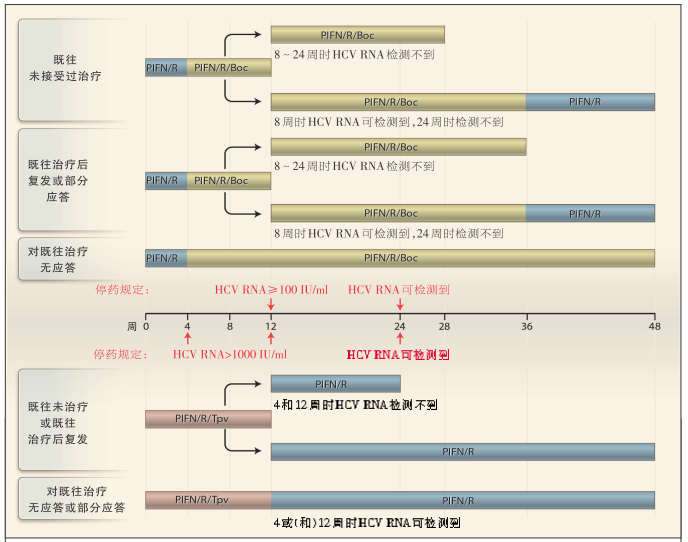
图 2 以博赛泼维和特拉泼维为基础的方案治疗 HCV 感染
以博赛泼维为基础的方案和以特拉泼维为基础的方案在以下几个方面存在差异:第一是关于各种不同类型的患者[既往未接受过治疗的患者与既往接受过治疗的患者(包括初始应答后复发、部分应答和无应答的患者)相比]的特异性治疗方案方面;第二是关于联合治疗的计划和疗程方面;第三是关于根据患者的应答在什么节点改变疗法以及在什么节点停止治疗方面。特拉泼维通常是在治疗的前12周内与聚乙二醇干扰素和利巴韦林一起给药[聚乙二醇干扰素α-2a,180 μg/w,或聚乙二醇干扰素α-2b,1.5 μg/(kg体重·w),联合应用利巴韦林,体重≤75 kg的患者为1000 mg/d,体重>75 kg的患者为1200 mg/d],然后根据患者对三联疗法的病毒学应答情况(应答指导的治疗),停用蛋白酶抑制剂,继续应用聚乙二醇干扰素和利巴韦林,总共治疗24周或48周。相反,博赛泼维是在开始聚乙二醇干扰素和利巴韦林(和上述剂量相同)治疗4周后开始应用,也是根据病毒学应答情况,持续至共计28周或48周。一般来说,对于这两种方案,肝硬化患者应接受与既往治疗无应答患者同样的治疗。停药规定:对于特拉泼维为基础的方案,4周或12周时HCV RNA>1000 IU/ml的患者应停用所有3种药物;对于博赛泼维为基础的方案,12周时HCV RNA≥100 IU/ml的患者应停用所有3种药物;对于这两种方案,24周时HCV RNA检测不到的患者均应停止治疗。Boc表示博赛泼维,PIFN表示聚乙二醇干扰素α,R表示利巴韦林,Tpv表示特拉泼维。
三联疗法方案的挑战
尽管批准的三联疗法方案比无蛋白酶抑制剂的聚乙二醇干扰素和利巴韦林方案更有效,但它们有额外的副作用,并且坚持治疗也相当复杂,因为患者必须服用越来越多的药丸,且治疗计划要求每8小时服用1次。博赛泼维最常见的副作用为贫血、中性粒细胞减少和味觉障碍(味觉改变),特拉泼维最常见的副作用为贫血、皮疹和肛门直肠不适。贫血(血红蛋白水平<10 g/dl)发生于36%~50%的病例中,是需要处理的、最具挑战性的并发症。应用红细胞-刺激性药物处理贫血已经取得了一些成功,但这些药物有严重的副作用,花费高,并且未被批准常规应用于慢性丙型肝炎患者中。研究已表明,减小利巴韦林剂量(即使早在2周时,以及低至每日600 mg的水平)是处理贫血的一种有效策略,是被建议的第一种方法。
关于药物之间的相互作用,还有另一个注意事项,博赛泼维由醛-酮-还原酶和Cyp3A4/5途径代谢,而特拉泼维由Cyp3A途径代谢。这两种分子均为Cyp3A4和P-糖蛋白转运蛋白抑制剂,Cyp3A酶在肝内含量丰富,参与许多药物的代谢,在进展期肝病中,这些酶的活性降低。因此,当服用这些药物时,不仅应考虑到同时服用的(其他)药物对博赛泼维和特拉泼维浓度的影响,而且还应考虑到博赛泼维和特拉泼维对其他药物浓度的影响。许多药物(如某些他汀类、抗抑郁药、抗痉挛药、镇痛药和镇静剂)禁忌与这些药物同时服用。对博赛泼维和特拉泼维处方的所有医师均强烈建议,在应用这些药物之前,要检查药物之间相互作用的影响,可从一些有用的网站、随同药物发放的处方信息以及综述文章中获得重要的信息。
抗病毒药物的耐药是另一个引人关注的重要事项,当这些药物作为单药治疗时,早至开始用药后4天即可以发生耐药。蛋白酶抑制剂类的各种药物有相似的耐药突变模式,这意味着如果应用一种药物出现耐药-相关突变体时,同类中的另一种药物也会无效。因此,如果患者对所批准方案中的一种不再有应答,就不应采用另一种方案进行治疗。一旦停药,耐药相关的突变体会随着时间的延长而消失,这可能是因为它们不像野生型病毒那样可以有效复制。1例患者停止治疗后,某些突变可在病毒种群中持续3年或更长的时间。应向患者强调,应遵守所用的方案以及饮食中的注意事项(使药物能够最大程度地被吸收),以减少抗病毒药物耐药的发生。
通常对聚乙二醇干扰素和利巴韦林应答率较低的难治性人群,例如肝硬化或合并感染人类免疫缺陷病毒(HIV)的患者以及肝移植后的患者,应用这些获批方案的有效性数据尚不充分。在博赛泼维和特拉泼维的3期试验中,肝硬化患者大约仅占研究人群的10%,与没有肝硬化的患者相比,肝硬化患者的持续病毒学应答率更低。肝硬化患者的数量较少,他们对应答指导策略的应答率有较低的倾向,因此,肝硬化患者应接受48周的治疗。在初步研究中,合并感染HIV患者与无合并感染患者的应答率相似。由于药物间的相互作用以及严重的副作用,将批准的方案用于接受肝移植后的患者是有问题的。
三联治疗的指征
批准的三联疗法方案的应用指征与聚乙二醇干扰素和利巴韦林的指征一样,患者必须有明确的病毒血症,无治疗禁忌证,且无严重的并存疾病。对于进展期纤维化[肝活检伊沙克纤维化评分为4、5或6(分数范围从0到6,评分越高,表明纤维化程度越重)](见补充附录,与本文全文一起可在NEJM.org查看)的患者,考虑立即开始治疗尤为重要,因为这些患者疾病进展的危险最大。目前已经肯定确立了持续病毒学应答的益处(肝功能失代偿率更低,症状改善,肝脏相关性死亡危险降低,尤其是在晚期肝病患者中)。由于某些原因,博赛泼维和特拉泼维的应用未能显著改变治疗的危险-效益比值。首先,三联治疗的副作用较聚乙二醇干扰素和利巴韦林更重;其次,从治疗获益最多的患者即有肝硬化患者的应答率仍相对较低;再次,对治疗无应答的大多数患者可发生对抗病毒药物的耐药。在不远的将来,可能会有更好、可能更安全的无干扰素方案。
对哪些基因1型HCV感染患者应该考虑使用当前批准的方案进行治疗?既往未经治疗的无肝硬化患者以及对治疗产生初始应答、但随后在停止治疗后又复发的患者(已经有报告显示这两类人群的应答率较高)是良好的治疗人选(图 3)。但对既往未接受过治疗的、疾病轻微的患者,或许可推迟治疗,等待有更强效和更安全方案问世。肝硬化患者和对既往治疗无应答的患者虽从三联疗法中获益最大,但应答率最低。一旦完成对治疗益处、应答的可能性以及治疗潜在副作用的探讨,应对所有患者建议使用个体化方法。所批准的两种三联方案的有效性相似(尽管未进行过直接比较)。在选择一种方案时,应对诸如患者的偏爱、蛋白酶抑制剂给药疗程、副作用情况以及费用等因素进行考虑。
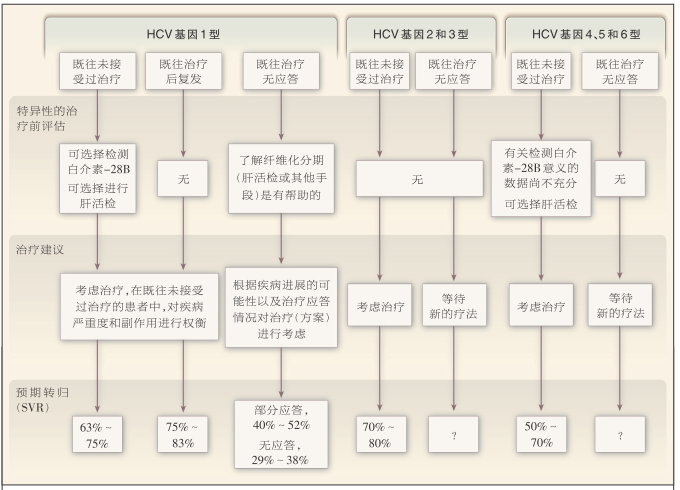
图 3 根据基因型对 HCV 感染进行治疗的方法
本图显示的是既往未接受过治疗和接受过治疗患者的治疗方法,接受过治疗的患者包括初始应答后复发的患者和无应答的患者。特异性治疗前评估指的是一些特殊考虑,如基因检测(白介素-28B基因型),肝活检或无创伤性检查,以确定肝纤维化分期。部分应答的定义为早期病毒学应答(12周时,HCV RNA水平的降低>2 log10 或检测不出)、但治疗结束时可检测到HCV RNA,无应答的定义为对聚乙二醇干扰素和利巴韦林标准疗法没有产生早期病毒学应答。对基因2或3型HCV感染的治疗为聚乙二醇干扰素α-2a,180 μg/w,或聚乙二醇干扰素α-2b,1.5 μg/(kg体重·w),与利巴韦林800 mg/d联合,治疗24周;对基因4、5或6型感染的治疗是根据体重确定利巴韦林剂量(体重≤75 kg的患者为1000 mg/d,体重>75 kg的患者为1200 mg/d)的同样联合方案,治疗48周。对于无肝硬化、病毒水平较低、并且获得快速病毒学应答(治疗4周时HCV RNA检测不到)的基因2型HCV感染患者,采用12~16周的较短疗程、基于体重的利巴韦林治疗可能同样有效49。关于较新的全口服方案,目前已完成3期研究,结果显示,在用于治疗既往未接受过治疗和对既往干扰素治疗无应答的基因2或3型感染患者方面有希望51,52。SVR表示持续病毒学应答。
基因2~6型HCV感染的治疗
联合聚乙二醇干扰素和利巴韦林仍是基因2、3、4、5和6型HCV感染的建议治疗(图 3)。一项联合应用聚合酶抑制剂(sofosbuvir)和利巴韦林治疗12周研究的初步结果显示,基因2或3型HCV感染患者的持续病毒学应答率为100%。正如在本期杂志中所报告的,采用同样方案进行口服联合治疗的两项3期试验显示,基因2型感染患者的应答率相似(两项研究中为93%和97%),但基因3型感染患者的应答率则要低得多(两项研究中为56%和61%),表明基因3型感染患者仍需要更好的口服方案。各种直接作用抗病毒药物对其他基因型的活性也处于研究中。
临床研发中的治疗
直接作用的抗病毒药物
博赛泼维和特拉泼维的主要缺陷是它们对基因1型以外的HCV感染患者的抗病毒治疗有效性有限,且它们的耐药基因屏障较低(表 1)。大约有十几个处于2~3期研发中、较第一代药物更好的第二代蛋白酶抑制剂。两类NS5B聚合酶抑制剂(核苷酸和非核苷酸类似物的抑制剂)正处于研发中。核苷酸抑制剂的靶点是酶的保守核苷酸结合袋(nucleotide-bindingpocket),功能为链终止剂。而非核苷酸抑制剂与NS5B的其他区域结合,是变构抑制剂。大约有8种NS5A抑制剂和超过十余种的NS5B抑制剂处于2~3期研究中。表 1总结了这些较新药物的特性。目前正在进行所有上述药物联合或不联合利巴韦林或聚乙二醇干扰素的临床试验。对将NS4B和p7病毒蛋白作为直接作用抗病毒药物替代靶点的探索也正在进行中(表 1)。一般情况下,针对NS4B和p7药物的有效性不如那些针对NS3/4A、NS5A和NS5B的药物,并且其基因型的覆盖范围也相对较窄。
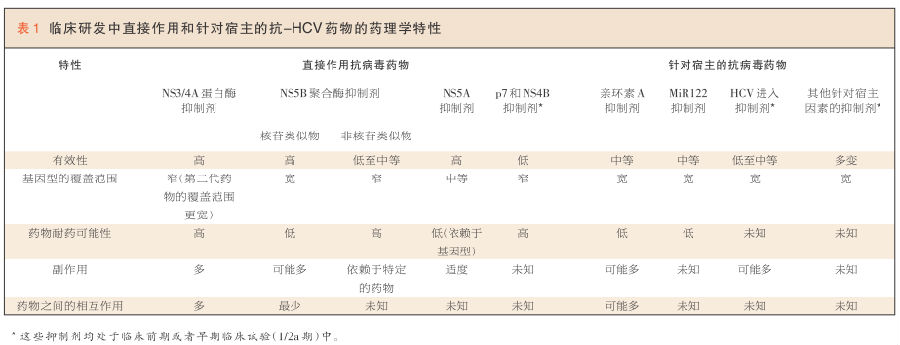
(右键点击图片,在新窗口中打开可查看大图。)
针对宿主的抗病毒药物
亲环蛋白A和miR122的抑制剂均是有希望的、针对宿主的抗病毒药物,目前均已进入2期或3期临床试验[图 1和表1]。Alisporivir是一种基因型覆盖范围较广的亲环蛋白A抑制剂,在一项14天的单药治疗试验中已经显示出可观的疗效(可使HCV水平约降低3 log10)。有研究者正在对相关的化合物诸如SCY-635和NIM811进行临床试验的验证。由于NS5A蛋白质可出现突变,故病毒可对这类化合物产生耐药,但病毒却还少对直接抗病毒药物产生耐药。对于既往接受过治疗和未接受过治疗的患者,alisporivir与聚乙二醇干扰素和利巴韦林的联合治疗的有效性已经表现出较仅用聚乙二醇干扰素和利巴韦林改善。由于alisporivir可能与数例重症胰腺炎病例相关,故目前(美国)食品与药物管理局暂停了对该药(上市申请)的办理。Miravirsen是一种针对miR122的药物,在一项2a期试验中,皮下给予该药,每周1次,单药治疗5周后,可使HCV水平适度下降(<3 log10),疗效似乎可持续至最后一剂应用后的数周,并且未发现耐药突变。
无干扰素方案
由于许多原因,无干扰素方案在慢性丙型肝炎的治疗中有一定的优势。在应用直接作用抗病毒药物的各种联合(用或不用利巴韦林)方面已经获得了相当大的进展。具有不同作用靶点的联合药物可引起相加或协同的抗病毒功效,同时还能降低抗病毒药物耐药的发生危险。识别出能够具有最大功效、最强耐药屏障以及最少的副作用的联合用药模式是一种挑战,什么是最终方案仍有待确定。目前,正在对蛋白酶、NS5A和聚合酶抑制剂的许多联合用药、用或不用利巴韦林进行评价。在一项概念验证性研究中,既往接受过治疗和未接受过治疗的慢性丙型肝炎患者接受一种无干扰素和无利巴韦林方案的治疗,该方案由聚合酶抑制剂RG7128(一种核苷酸抑制剂)和蛋白酶抑制剂danoprevir组成,治疗13天,继以聚乙二醇干扰素和利巴韦林治疗,在接受最大剂量治疗的患者中,有很大比例的患者仅在13天后即达到HCV RNA水平检测不出,表明不应用干扰素或利巴韦林也可清除病毒。
数项针对直接抗病毒药物其他联合的试验表明,接受治疗的患者可达到病毒清除。在联合应用蛋白酶抑制剂asunaprevir与NS5A抑制剂daclatasvir的一项研究中,研究者对既往治疗无应答的基因1a或1b型感染患者治疗了24周,结果显示,11例患者中有4例(36%)病毒清除。另外一项研究应用了同样的方案,但仅针对既往治疗无应答的基因1b型感染患者,结果显示,持续病毒学应答率达到90%。后面的这些研究强调了HCV亚型对完全由直接作用抗病毒药物组成方案应答的影响。联合一种直接作用抗病毒药物和一种针对宿主的抗病毒药物,可能能够避免因基因型的不同而产生不同应答的问题。最近的两项研究也显示了基因1型HCV感染患者接受其他口服(药物)联合治疗获得了较高持续病毒学应答率(80%~90%)。关于其他治疗方法的讨论,见补充附录。
HCV治疗的精准给药
生物学标志物和基因组医学的进展已经为丙型肝炎患者的个体化治疗方法提供了一种独特的机遇。各种临床特征(例如存在肝硬化)和病毒学特征(例如基因1型与基因2或3型相比)均可被作为治疗的标准,这已经被整合到目前的方案中。此外,监测治疗期间的病毒学应答也常常可以决定疗程的长短(应答指导的治疗)(图 2)。以前已经发现的、与聚乙二醇干扰素和利巴韦林应答有关的人口学和其他因素,也是对批准的直接抗病毒药物方案应答起重要决定作用的因素,这些因素包括年龄较轻(<45岁)、非黑色人种、较低的体质指数、无糖尿病病史、肝活检无肝硬化、基线病毒载量较低(<800000 IU/ml)以及HCV 1b亚型。
对于以干扰素为基础的治疗,新的生物学指标(例如血清IP10水平)和遗传学检测(例如确定IL28B基因的多态性)似乎有较强的预测价值。最近有研究发现,肌苷三磷酸酶基因的多态性可作为利巴韦林引起贫血的药物基因组学指标,但是,由于在普通人群中具有这种保护作用的多态性罕见,故筛查这些多态性就没有用处。最近,对根据IL28B基因型选择治疗方案的一项研究数据进行成本效益分析的结果表明,在有IL28B这种有利基因型的亚组患者中,持续病毒学应答率接近80%,故可首先进行聚乙二醇干扰素和利巴韦林治疗,如果初始治疗失败,随后再给予批准的直接作用抗病毒药物方案的治疗。尽管IL28B基因型的检测尚未被正式批准为医疗的标准,如果患者或医务人员想知道关于治疗应答可能性的额外信息,该检测可能会有帮助(图 3)。然而,由于更强的抗-HCV药物以及无干扰素方案正在研发中,这些指标可能不再有重要作用。
对慢性HCV感染自然史的研究已经表明,大多数HCV感染者的肝病进程缓慢,很少发展至出现危及生命的并发症。治疗HCV感染患者的另外一种个体化方法是仅对那些可能发生严重疾病的患者进行治疗,但在这些患者中,已发现的临床和基因指标并没有较强的预测作用,需要寻找更好的预测指标。
结论
如果过去可以预示未来,那么,HCV感染的治疗将可能会以轻快的步伐继续进步。许多有效的其他药物正处于临床产品研究线上,在未来的5年内,无干扰素方案有可能在HCV治疗领域中扮演主要角色。如果一个简单的治疗方案成为现实,(我们)将需要强有力的卫生保健基础设施来对数百万不知道自己情况的HCV感染患者进行辨别、检别分类和治疗。目前,美国卫生保健系统中的基础设施严重不足,在美国,由HCV感染引起的死亡率已超过由HIV感染引起的死亡率。对HCV感染的成功治疗在降低发病率和死亡率方面具有不可否认的长期益处。最具挑战性的问题可能并非是否有医疗手段可有效管理和治疗HCV感染,而是经济资源和社会责任是否能够胜任这一雄心勃勃计划的执行,以消除这一全球性的公共卫生问题。


































