摘要: 慢性乙型肝炎抗病毒治疗目前在临床上仍然是一个挑战。治疗的首要目的是预防肝病进展。由于病毒在受感染肝细胞内持续存在,多数患者需要长期抗病毒治疗。不完全病毒抑制和出现耐药是主要的问题。正确选择一线强效治疗以长期抑制病毒复制,可以最大限度防止治疗失败和耐药发生。临床研究已经证实,与低耐药屏障药物如拉米夫定、阿德福韦酯或替比夫定相比,高耐药屏障药物如恩替卡韦和替诺福韦酯的耐药率明显较低。处理治疗失败不仅需要严格的临床和准确的病毒学监测,还需要根据交叉耐药情况恰当地采用互补药物进行早期临床干预。有必要对多种抗病毒药物序贯治疗患者进行疗效和耐药的长期监测。确定新的治疗目标以改善现有抗病毒药物疗效仍是重要的研究热点。
抗病毒药物发生耐药的背景
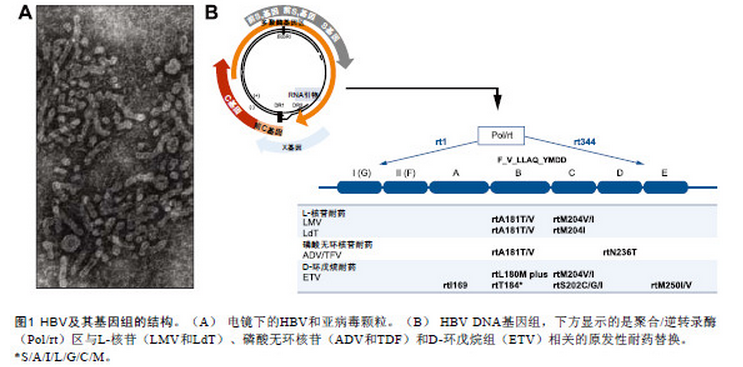
乙型肝炎病毒(hepatitis B virus,HBV)基因组为3.2 kb 部分双链DNA,由4 个重叠但移框的开放阅读框(open-reading frame,ORF ;图1) 组成。最长的ORF编码病毒逆转录聚合酶(P ORF),第二长的ORF 被称为“包膜”或“表面”(surface,S)ORF,位于P ORF内,编码病毒表面蛋白。另外2 个较小的ORF 分别编码前C - C 蛋白和X 蛋白,均与P ORF 部分重叠。尽管缺乏稳定的感染细胞模型,但HBV 的病毒复制周期相对较明确。HBV 复制包括2 个关键步骤。首先,作为病毒主要转录模板的HBV 共价闭合环状(covalentlyclosed circular,ccc)DNA - 微型染色体非常稳定。其次,HBV 逆转录聚合酶的错配倾向导致较高的核苷酸替换率,产生病毒变异株或准种,能对内源性(宿主免疫反应)和外源性选择(抗病毒治疗或病毒传播)压力产生快速反应。由于该准种池中预存了大量可以从免疫反应(前C 或HBeAg 逃逸)、预防性疫苗(疫苗逃逸)和抗病毒治疗(耐药)中逃逸的突变株,为HBV 提供了存活优势。正常情况下,肝细胞内HBV 复制不导致细胞病变,但病毒逃逸突变株的产生和选择可引起临床进程和HBV持续复制。宿主免疫反应反复激活,但不能成功地清除受感染肝细胞内的野生株和逃逸突变株,导致慢性乙型肝炎(chronic hepatitis B,CHB)相关的典型坏死性炎症和肝损害。而且,HBV 活动性复制与活动性肝病相关,近来一些亚洲的长期自然史研究证实病毒复制与临床结局有直接关联。
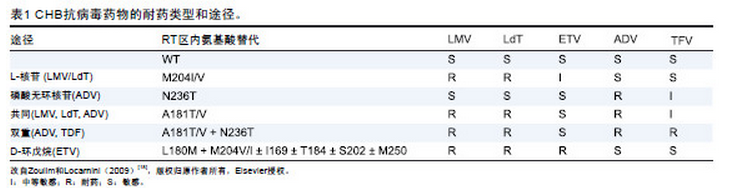
CHB 的有效治疗显著降低发病率和死亡率。疗效的影响因素包括不良反应、患者依从性差、原治疗方案不佳、感染耐药病毒株、由于药物特性导致的不恰当用药和个体遗传变异。在全球大多数地区,(普通或聚乙二醇化)干扰素和5 种核苷(酸)类似物[ nucleos(t)ide analogues,NA ] 已获批用于CHB 治疗。NA 直接抑制HBV 聚合酶逆转录酶活性。被批准的NA 包括拉米夫定(lamivudine,LMV),以及具有非自然左旋结构和相关左旋核苷的合成脱氧胞苷类似物替比夫定(telbivudine,LdT ;β - L - 胸腺嘧啶);另一组为磷酸无环核苷,包括阿德福韦酯(adefovir dipivoxil,ADV)即2’- 脱氧无环腺嘌呤磷酸酯类似物阿德福韦的前体,以及结构类似的替诺福韦酯(tenofovir,TDF);第三组为D - 环戊烷,这类药物中的脱氧鸟苷类似物恩替卡韦(entecavir,ETV)是迄今为止发现的最强效的抗HBV药物。这种根据NA 结构进行的分类与NA 耐药方式和途径有关,因此在临床中很有意义(表1,图1)。
抗病毒药物耐药定义为在抗病毒药物选择性压力下,病毒发生适应性突变,并对药物抑制作用的敏感性下降。突变分为两类:直接导致耐药的原发性耐药突变和继发或补偿性突变。原发性耐药突变可能伴随着复制能力的下降,继发或补偿性突变则可能恢复病毒复制能力。补偿性突变的重要之处在于其能够减少原发耐药突变对病毒株的有害影响。
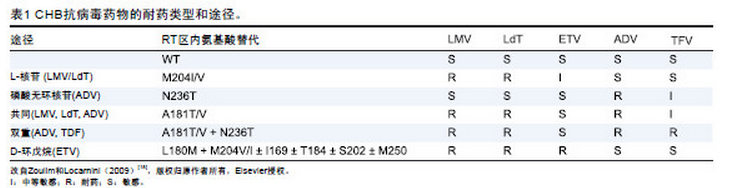
耐药发生由聚合酶基因突变开始,随后病毒载量上升,数周或数月后血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)水平上升,肝病进展(图2A)。LMV 耐药患者血清ALT 升高的风险通常与可检测到耐药株的持续时间相关。这类患者ALT 反跳(flare)的风险也较高,甚至可以伴发肝脏失代偿。一项LMV治疗严重纤维化患者的安慰剂对照试验显示,HBV 耐药对肝脏组织学和临床均有负面的影响。与LMV相反,ADV 耐药从动力学上来说通常更晚发生(图2B),但进展相同:起初检测到特异性聚合酶突变的变异株,随后出现病毒学突破,然后血清ALT 水平升高。在某些情况下,ADV 耐药也导致病情恶化和肝衰竭。
LdT、ETV 或TDF 耐药CHB 患者的临床预后数据有限,主要是由于根据体外交叉耐药数据可以更早地调整治疗。使用耐药谱互补药物(表1)改善耐药患者的治疗,有助于预防耐药相关的临床不良结局。NA耐药相关的临床危险因素包括高血清HBV DNA 水平、高ALT 水平和高体重指数。既往NA 治疗和治疗期间病毒应答不充分也是耐药的预测因素。通常NA 耐药发生与以下6 个因素相关:(1)病毒复制的数量和速度;(2)病毒聚合酶的保真度;(3)NA的选择性压力(效力);(4)肝内可供病毒复制的空间;(5)NA 耐药HBV 的复制适应性;(6)NA 耐药基因屏障。以上内容详见最近发表的一篇综述,此处不具体讨论。
CHB患者NA耐药模式
L-核苷
拉米夫定耐药替换
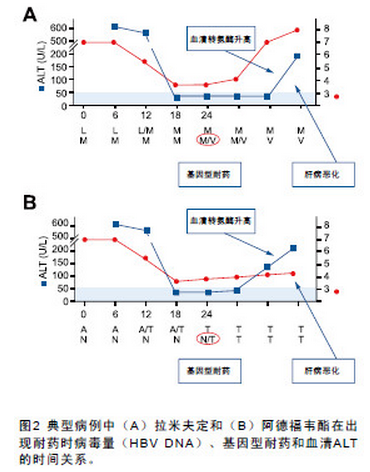
LMV 耐药定位于HBV P ORF 的酪氨酸- 蛋氨酸-天冬氨酸- 天冬氨酸(tyrosine - methionine - aspartate- aspartate,YMDD) 活性区或C 区( 图1)。原发性耐药突变导致蛋氨酸被亮氨酸或异亮氨酸,或偶尔被丝氨酸取代,称为rtM204I/V/S。尽管rtM204I 可独立存在,但仅在伴随其他改变,尤其是rtL180M(位于B 功能区)的情况下发现M204V/S。其他原发性替换包括rtA181T/V 也会造成LMV 耐药。补偿性改变发生于HBV P ORF 的其他功能区,如rtL80V/I、rtV173L和rtT184S。
LMV 耐药率以每年14% ~ 32% 的比例上升,48 个月时耐药率超过70%。LMV 的2 个耐药突变(rtM204V/I和rtA181T)对LdT 和左旋核苷结构组的其他药物如恩曲他滨(emtricitabine,FTC)和克立夫定(clevudine,L-FMAU)交叉耐药(见表1)。rtM204V/I 替换对ADV或TDF 无交叉耐药(见表1),但rtA181T/V 对ADV 交叉耐药。值得注意的是:rtM204V/I 和rtL180M 会降低对ETV 的敏感性(见表1)。
替比夫定耐药替换
LdT 是“非自然”的(D -)脱氧胸腺核苷左旋异构体,能有效转换为有活性的三磷酸代谢产物,其在细胞内的半衰期很长。LdT 治疗中发现的主要耐药替换为位于HBV P ORF 的rtM204I,并且对拉米夫定交叉耐药(见表1)。其他特异性耐药突变包括共同通路的 rtA181T/V(表1,共同通路)和rtL229W/V。在替比夫定的注册研究中,LdT 12 个月耐药率为4%,单药治疗24 个月后超过30%。
磷酸无环核苷
阿德福韦酯耐药替换
ADV 耐药首先与HBV P ORF B 区(rtA181T)和D 区(N236T) 的替换有关。ADV 耐药率低于LMV,2 年耐药率约为2%,5 年耐药率达29%。在体外试验中,HBV P ORF 的ADV 相关突变仅导致ADV 敏感性中度降低,对TDF 部分交叉耐药( 见表1)。rtN236T 突变对LMV 敏感性无明显影响,但rtA181T 突变对LMV 和LdT 交叉耐药(见表1)。近来发现另一种突变(rtI233V)对ADV 耐药。在临床研究中发现,约2% 的CHB 患者发生rtI233V 改变,但其在ADV 治疗失败或无应答中的确切作用仍不明确。
替诺福韦酯耐药替换
TDF [ 9 -(2 - 膦酰甲氧基丙基)腺嘌呤] 与ADV 密切相关,同属磷酸无环核苷酸。与ADV 相似,TDF 也需要二磷酸化过程使其转化为活性形式。TDF对HIV 和HBV 均有效,已成功用于治疗HIV/HBV 重叠感染的患者。与ADV 一样,TDF 对rtM204V/I 突变的LMV 耐药患者同样有效。如表1 所示,与ADV 耐药相关的原发性突变(rtA181T/V 和/ 或rtN236T)可降低TDF 的疗效,无论是在体外还是在体内试验中。在最近2 项ADV失败患者应用TDF 治疗的临床研究中,尽管在基线时测得的ADV 耐药突变相同,但病毒血症的演化模式时有不同,病毒水平下降的速度也时快时慢。提示在TDF存在的情况下,基因组在以上位点以外也复杂多变,可能影响突变株的适应性和病毒清除动力学。Patterson 等在研究中发现,TDF 挽救性治疗对rtA181T/V 和rtN236T双重突变的HBV 疗效不佳(表1)。ADV 耐药相关替换对后续TDF 疗效的影响有待进一步研究。
D-环戊烷组
恩替卡韦耐药替换
ETV 耐药最早见于已发生LMV 耐药的HBV 患者。ETV 耐药需要rtM204V/I(± L180M) 加上其他ETV 的“特征性”突变:包括B 区的rtI169T 或rtS184G、C 区的rtS202G/I 或E 区的rtM250V(表1)。在不存在rtL180M + rtM204V/I 突变的情况下,rtM250V 导致病毒对ETV 的敏感性降低10 倍,而仅有rtT184G 和rtS202G/I 突变的影响甚微。相反,当rtL180M + rtM204V 突变同时存在时,药物敏感性降低超过100 倍。根据近期的报道,初治患者对ETV 原发性耐药至少需要3 个位点同时存在替换,提示ETV具有高基因屏障。ETV 初治患者的第1 年耐药率几乎为零,6 年的耐药率也很低(约1%)。但是LMV 治疗失败后改为ETV的患者病毒学突破发生率高达50%,限制了ETV 在挽救性治疗中的应用。
耐药途径
与CHB 治疗失败相关的原发性耐药替换见表1和图1。迄今为止,批准用于治疗CHB 的药物发生原发性治疗失败归因于HBV P ORF上8个密码子的改变。这些突变通过以下5 种不同途径指导病毒演化:
• L - 核苷途径(rtM204V/I)。LMV 和LdT 治疗选择出rtM204V/I,易发生ETV 耐药。
• 磷酸无环核苷途径(rtN236T)。ADV 和TDF 治疗选择出和/ 或强化rtN236T。
• 共同途径(rtA181T/V)。L - 核苷和磷酸无环核苷类药物治疗均可选择出rtA181T/V,见于40% 的ADV治疗失败患者中,但LMV 治疗失败中仅占5% 以下。ADV 和TDF 治疗可强化rtA181T/V。
• 双重途径(rtA181T/V + rtN236T)。TDF 治疗强化这些突变株,抗病毒效果显著下降,导致持续病毒血症。
• D - 环戊烷/ETV 初治耐药途径(rtM204V/I ±rtL180M 和rtI169、rtT184、rtS202 或rtM250 之中的至少一个)。ETV 选择出耐药株需要3 个突变。因此,ETV 初治患者的耐药率极低(表1)。
多重耐药
单药治疗可促使多重耐药(multi - drug resistant,MDR)HBV 病毒株产生,尤其是患者采用有重叠耐药谱所有接受NA 治疗的患者都应当密切监测治疗期间的病毒学应答、病毒学突破、停药后应答的持久性以及病毒学复发。应当每3 个月检测一次血清HBV DNA,但如果患者依从性良好且使用的是高基因屏障的强效药物(ETV 或TDF),检测频率可适当降低。抗病毒治疗失败可能归因于某种特定的机制,因此后续治疗的临床指征和反应各不相同。因此,对依从性好的患者,区分原发性无应答、部分病毒学应答和由抗病毒药物耐药引起的病毒学突破(病毒反跳)非常重要。的抗病毒药物序贯治疗(如LMV、ETV 序贯治疗,LMV、ADV 序贯治疗或ADV、TDF 序贯治疗)时(见表1)。克隆分析显示MDR 通常由同一基因组序贯产生获得性耐药突变造成;由这种方式选择出来的突变株可能对多种药物完全耐药。研究显示如果“加用一种药物”的联合治疗策略不能快速抑制病毒,尤其是当存在充足的复制空间时[即坏死性炎症活动导致肝细胞增殖或预先存在的逃逸突变株导致移植后的肝脏不能被乙型肝炎免疫球蛋白(hepatitis B immune globulin,HBIG)所保护],则可能产生MDR。这些发现强调了在抗病毒治疗时需要完全抑制病毒。
一种特殊的单个氨基酸替换可导致MDR(见表1),即rtA181V/T 替换,可导致L - 核苷类的LMV 和LdT及磷酸无环核苷类的ADV 和TDF 敏感性均有下降。因此,与在HIV 治疗时相同,对治疗失败患者进行基因型检测(耐药检测)以确定病毒耐药突变谱和根据循环中的主要病毒株进行调整治疗,具有重要的临床意义。
原发性无应答
治疗12 周病毒载量下降不足1.0 log10 IU/mL 考虑为原发性无应答。原因可能是依从性差或个体差异导致药物无法发挥抗病毒作用。根据体外表型分析结果,应答不充分可能是由于宿主药理作用和/ 或患者依从性的原因,而不是由于药物敏感性下降。随着更强效药物如TDF 和ETV 的出现,这种以往常见于ADV治疗中的现象频率有所下降。当出现原发性无应答时,应当调整抗病毒治疗以防止疾病进展和随后出现耐药变异株的风险。因此治疗12 周的时间点对于决定抗病毒方案和评估治疗依从性非常重要。
部分应答
部分应答是指病毒量的下降无法达到一定的阈值,患者难以获得组织学改善和最小耐药风险。欧洲肝病协会临床实践指南推荐的标准之一是治疗中HBV DNA低于检测下限;因此,部分应答定义为治疗期间采用实时聚合酶链反应(polymerase chain reaction,PCR)方法仍可检测到HBV DNA。
值得注意的是,定义部分应答的时间点尚未明确。事实上,低耐药基因屏障的抗病毒药物如LAM 和LdT,治疗24 周的抗病毒应答可以预测其后的耐药率。ADV 发挥对病毒血症水平的抑制作用较其他NA(如LMV、ETV、LdT 或TDF)慢。因此倾向于用治疗48 周的时间点来预测耐药,因为这一时间点的病毒载量可以预测此后发生耐药的风险。对于更强效和高基因屏障的药物如ETV 和TDF,治疗1 年HBV DNA 低于检测下限的患者比例明显改善,在HBeAg 阳性患者中达67% ~74%,在HBeAg 阴性患者中达90% ~ 91% 。由于在ETV 和TDF 治疗期间,随着时间的推移,病毒抑制率持续升高,因此调整治疗的时机主要取决于病毒载量降低的速度,尤其是治疗之初病毒载量水平很高的患者,需要额外数周的时间使HBV DNA 达到PCR 检测水平以下。因此,相比在某一特定时间点作单次检测,监测病毒载量下降的模式更有意义,主要由于前者可能会对疗效预测造成误导。尽管缺乏来自长期临床研究的数据,但目前仍建议在持续低病毒血症或HBV DNA 水平不能持续下降时调整治疗,以最大限度地抑制病毒和降低耐药率。
病毒学突破:病毒反跳
出现耐药病毒株是病毒学突破的典型结果。其定义为依从性良好的患者治疗期间HBV DNA 从最低值上升至少1.0 log10 IU/mL,并经二次检测证实。因药物的选择性突变不同,病毒载量可缓慢上升,使得反跳的诊断变得困难(图2B)。通常先检测到耐药基因型(图2A、B),即耐药突变。此时如果未调整治疗,血清病毒水平上升数周或数月后,ALT 水平上升(生化学突破),随后出现肝病进展(临床突破)。耐药突变相关的病毒载量上升取决于突变株的适应性;有意义的是,聚合酶基因区的耐药突变累及重叠的S 区,可影响病毒从被感染的肝细胞中分泌的能力或其感染力(见表2),导致病毒载量缓慢但进行性上升(图2B)。因此,升高1.0 log10 IU/mL 的规则可能难以适用于不严格按照每3 个月一次监测病毒载量的患者。
评估治疗应答和失败的方法
病毒载量的检测方法和监测
病毒载量的检测对监测抗病毒疗效和确证耐药病毒的存在均很重要,因为几乎所有NA 耐药最初都是通过抗病毒治疗未中断,但病毒载量持续上升来识别。近来使用敏感的HBV DNA 检测法,可以在耐药株比例还很低时,检测到因产生耐药株而上升的病毒量。因为除耐药以外的原因(如依从性差和/ 或基因药理学因素)也可以影响病毒量,所以不能简单推断病毒量上升即提示耐药,耐药HBV 只能通过基因型分析和/ 或表型分析来证实。
基因型分析:病毒基因组
测序分析/耐药突变检测
为了检测可能存在的基因型耐药,发生病毒学突破时分离出HBV 聚合酶区的核苷酸和根据其推算出的氨基酸序列应当与同一患者治疗前分离出的HBV 序列作对比。当缺乏治疗前样本时,患者病毒学突破时的序列数据应当与同一HBV 基因型已发表的共有序列作对比。基因分析依赖于DNA 测序或杂交。基于测序的方法包括标准的基于病毒群PCR 产物克隆和限制性片段长度多态性分析。
病毒群序列分析
只有某一特定突变株在准种池中的比例≥ 20%,才可以被基于直接PCR 的DNA 序列分析方法检测到。析可克服这一限制,但需要分析大量的克隆。克隆分析工作量大,需要高技术人员,不适用于大规模筛查。除Visible Genetics(西门子医学诊断,Tarrytown,纽约)研发出的TRUGENE 基因型检测法外,其他基于PCR 的检测方法尚未被商品化或尚未获当局批准,还只是缺乏标准化的“内部实验方法”。
单核苷酸多态性(single nucleotide polymorphism,SNP)检测/杂交 是基于杂交的基因型分析方法的代表,可检测单个核苷酸错配,包括以下几种:
(1) 对小DNA 片段的质谱分析[ 基质辅助激光解吸电离- 飞行时间质谱(matrix - assisted laser -desorption ionization time of flight mass spectrometry,MALDITOFMS)]。可识别仅占总病毒群1% ~ 5% 的突变株。
(2)已有的商品化线性探针法INNOLiPA(Innogenetics,Ghent,比利时)。其原理是应用一系列结合在膜上的寡核苷酸探针对野生型序列和已知耐药突变株进行差别杂交。当突变株仅占病毒总数的5% ~ 10% 时,LiPA 法仍可检出,该方法对病情进展的高风险患者具有优势。
(3)DNA 芯片技术。以微芯片技术为基础,使用寡核苷酸微阵列进行测序,具有提高敏感性和检测新突变株的能力。这种方法相对来说较易应用于同时检测大量单一突变和识别多态性。所有基于杂交的方法都有一个主要缺陷,即特异性:每一种突变均需要新的特异性探针,自然序列的多样性使探针的识别能力和特异性降低。而且,序列的前后关系和二级结构也可以影响敏感性,且其中占少数的亚群(占病毒总量不足10% 的病毒株)可能检测不到。
准种研究和超深测序法
焦磷酸测序(pyrosequencing) 是相对较新的测序方法。其原理是通过检测dNTP 添加到测序引物的3’末端过程中产生的焦磷酸基团(PPi)数量来检测DNA 聚合酶的活性,可以通过合成互补链来检测单链DNA 序列,一次1 个碱基对,检测每一步加入的碱基。目前焦磷酸测序的主要缺点是:单次测序的最大长度比传统链终止测序方法短。焦磷酸测序是目前检测低比例(0.1%)耐药株最敏感的方法,如果相关仪器和数据的生物统计学处理价格合理,将来有望成为可选的方法。
表型分析和交叉耐药检测
目前已经开发了几种体外检测耐药突变株表型的分析方法。这些方法对鉴定特定突变谱在耐药中的作用和突变株的交叉耐药谱均十分重要。在研究HBV 耐药的过程中,以下2 种方法尤其常用:病毒聚合酶测定和检测病毒复制的细胞培养模型。
因为NA 耐药突变位于HBV P 区,有几位学者在体外无细胞环境下测定了耐药突变对病毒聚合酶活性的影响。研究HBV 聚合酶活性的主要模型是基于其能利用杆状病毒载体在昆虫细胞中表达,从而可以研究其在纯化的病毒核衣壳中的活性。HBV 聚合酶研究的替代模型使用一种无细胞法,即鸭HBV(DHBV)聚合酶在网织红细胞裂解物系统中的表达。总之,在无细胞聚合酶测定法中获得的交叉耐药数据通常与组织培养实验中获得的数据一致;但也观察到药物对病毒DNA 合成的抑制作用在无细胞系统和组织培养中存在一些差异,提示在对特定药物的抗病毒活性进行总体评价时,应当考虑到NA 的细胞内代谢可能是非常重要的因素。
目前已经开发了几种组织培养模型用于研究HBV耐药,对理解抗病毒耐药的机制或提供交叉耐药数据均有一定的帮助,同时还可以提供病毒适应性的重要数据。其原理是将感染性的突变HBV cDNA 克隆通过短暂转染或杆状病毒转移载体转入肝癌细胞系,或构建永久表达HBV 耐药株的细胞系。突变株基因组可通过定位突变法或克隆自然产生的变异株获得。取决于不同的方法,可以体外测定单一病毒株或患者中自然产生的混合病毒株表型。
由于技术的复杂性和体外分析的局限性,很少有研究通过体外试验分析耐药突变株的感染性和适应性。P 区突变可导致重叠的S 区突变(表2),这一点具有重要意义。P 区和S 区基因的联合突变可导致病毒适应性下降,表现为选择动力学差异。尽管如此,由于目前仅有的2 个用于研究全病毒复制循环的细胞系统(人原代肝细胞和HepaRG 细胞系)感染性较低,导致这类研究不能很好地进行。
抗病毒耐药突变株的体外研究可使用鸭或土拨鼠模型中的DHBV 或WHV;然而,聚合酶相关的耐药模式可能因物种而异。人HBV 耐药突变株的研究局限于黑猩猩和人化的SCID 大鼠模型,但获得的数据有限。
治疗失败的处理
治疗失败的处理在近年来发生了明显的变化。事实上,在出现强效抗病毒药物和病毒学检测手段以后,治疗失败的概念不仅包括经典的病毒学突破,还可以扩展到部分病毒学应答。在任何情况下都应当严格检查治疗依从性,并强调在目前交叉耐药数据(表1)的背景下,根据患者特异HBV Pol DNA 序列的耐药谱来处理耐药的必要性。
治疗依从性评估
抗HBV 治疗中依从性良好对维持最大限度抑制HBV 复制非常重要。依从性不佳可导致血清药物浓度明显下降(取决于漏服药物的次数和药物半衰期),并导致病毒载量上升。CHB 患者NA 治疗的依从性研究显示,近40% 的患者未完全依从,明显影响病毒抑制率。ADV 的部分应答也与依从性差有关,当然也与高体重指数等其他药理学参数有关。依从性不佳相关的低水平病毒复制增加了NA 的效力压力,随后会导致耐药风险上升。特异性治疗依从性问卷和血药浓度监测有助于患者的治疗。事实上,HIV 感染者抗病毒治疗的研究已显示,与药物效力与耐药之间的关系类似,依从性和耐药之间也存在一种钟形曲线的关系。来自该研究的数据还提示使用更强效的药物可能使依从性差的患者耐药率降至最低,因为即使依从性水平很低,在接受更强效治疗方案的患者中HIV RNA 可检出率和耐药率也较低。
在临床实践中不易评估治疗的依从性。研究显示,与计数药片或电子监测(MEMS)方式相比,基于自我报告的依从性数据可能虚高。教育水平、健康保险类型、文化因素以及药物低报销率均对药物依从性有统计学意义的影响。所有这些数据提示,为改善临床实践中的抗病毒疗效,对患者进行教育和对药物依从性提供临床上的支持十分重要。
根据交叉耐药调整治疗
交叉耐药定义为由于使用某种药物选择产生改变,使得患者对另一种未使用过的药物耐药(见表1)。由某一种NA 选择出的耐药相关突变对同一结构组的其他药物至少在一定程度上耐药,也可以降低另一化学组NA 的敏感性。初治药物的选择和随后的挽救治疗应当以交叉耐药知识为基础,即第二种药物与第一种治疗失败的药物耐药谱不同。这一点尤其重要,因为被先前治疗选择出的耐药突变株会被储存在肝脏的病毒cccDNA 库中。最近还强调了加用交叉耐药谱不同的NA 联合治疗方案的优势,基于病毒耐药途径的交叉耐药谱总结于表1。加药方案的优势还在于提高了耐药屏障和药物效能,降低了耐药发生的可能性。
耐药的处理
依从性良好的患者发生病毒学突破与病毒耐药有关。以往曾经使用过NA 或初治患者基线HBV DNA 水平高、治疗后HBV DNA 水平下降缓慢,以及部分病毒学应答均与耐药相关。对于耐药患者,应当在ALT 升高之前,通过HBV DNA 水平监测(如有可能,还应当检测耐药基因谱)尽早确定;并以此为基础为患者制定最佳的治疗策略。临床和病毒学研究也证实了早期(在病毒载量上升时即刻)调整治疗的益处。一旦出现耐药,应该以抗病毒最有效,同时发生选择性耐药株风险最小的方案开始挽救性治疗。因此,推荐的方案是加用第二种与先前药物不在同一交叉耐药组的药物(即L- 核苷vs 磷酸无环核苷vs D- 环戊烷)。
尽管加用一种无交叉耐药的药物以防止MDR 株的出现和提高耐药屏障具有很强的病毒学理论依据,然而基于目前相关的临床短期观察,仍倾向于推荐换用一种高耐药屏障且不产生交叉耐药的药物;这一选择目前正在各国家和国际性指南中积极讨论,并且需要通过长期临床和分子病毒学研究的严格评价,才能对这一关键问题下定论。而且,更换药物的策略不适用于经过多种单药治疗的患者,这类患者应当采用加药联合治疗的策略,以最大限度地降低治疗失败的风险。
表1 显示了最常见耐药HBV 变异株的交叉耐药数据。治疗调整应当遵循以下几点原则:
(i)LMV 耐药: 加用TDF( 如无TDF, 加用ADV);也有指南建议更换为TDF ;但由于高耐药率和低药效,不推荐更换为ADV。
(ii)ADV 耐药:推荐更换为TDF(如可行)和加用第二种无交叉耐药的药物。如果以往未使用过LMV,更换为ETV 对ADV 耐药患者也有效。如基因型耐药监测显示rtN236T 替换,考虑LMV 或LdT 联合TDF,或更换为Truvada(TDF 和FTC 的复合制剂);另一方面,如患者先前未使用过LMV,也可更换为ETV。如果存在rtA181V/T 替换, 无论是否合并rtN236T, 均推荐ETV 联合ADV 治疗,或更换为TDF 联合ETV,如患者既往未使用过LMV,也可考虑更换为ETV。
(iii)LdT 耐药:推荐加用TDF(如无TDF,可加用ADV);有些指南中也推荐更换为TDF ;但由于高耐药率和低药效,不推荐更换为ADV。
(iv)ETV 耐药:推荐加用TDF。
(v)TDF 耐药:至今未证实TDF 的原发耐药。建议由参比实验室通过基因分析和/ 或表型分析来确定交叉耐药谱。对于TDF 耐药的患者可加用ETV、LdT、LMV 或FTC,但应以基因分析测定的耐药谱为根据(表1)。
值得注意的是,某些联合方案在长期治疗中的安全性未知,联合治疗并不总是能有效地充分抑制病毒。这些建议是根据“理想世界”的治疗理念作出的,并未考虑费用及药物能否获得。
原发性无应答
原发性无应答和部分应答的处理
可能由于ADV 药效较弱,相比其他NA,原发性无应答在AVD 治疗的患者中更常见(约10% ~ 20%)。对ADV 无应答的患者应当尽早更换为TDF 或ETV 治疗。对LMV、LdT、ETV 或TDF 治疗原发性无应答者罕见;对于这些患者,依从性水平的判断十分重要。对于依从性良好的原发性无应答患者,分析HBV 聚合酶的NA 耐药突变有助进一步治疗(见表1)。
部分病毒学应答
部分病毒学应答可见于使用任何NA 治疗的患者中。依从性的检查对这些患者也十分重要。对LMV、ADV 或LdT 部分病毒学应答的患者有2 种治疗策略:尽早(治疗24 周)更换为一种更强效的药物(ETV 或TDF)或加用一种无交叉耐药的强效药物。介于以上原因,并参照体外研究数据,如果HBV 变异株已经对ADV 耐药(即rtA181T/V ± rtN236T),则不推荐TDF单药治疗,因为这些药物属于同一化学组(磷酸无环核苷类)。当然,还需要更多数据来全面阐释这种情况(具体讨论见下文)。
在TDF 或ETV 部分应答的情况下,推荐更换或最好加用其他药物以达到HBV DNA 在检测水平以下的目标。但这些方案的效果并未经过大型多中心临床研究证实。
持续低病毒血症和病毒载量一过性波动(blips)
持续性极低病毒血症已成为高耐药屏障药物(ETV和TDF)治疗中出现的新问题。事实上,目前实时PCR方法对HBV DNA 的检测下限可达10 ~ 15 IU/mL,而在较早的III 期临床试验中采用的PCR 法检测下限约为60~ 80 IU/mL。在ETV 或TDF 长期治疗过程中,高达5%的初治患者仍维持HBV DNA 阳性。通常来说,如此低水平的病毒血症无法进行包括病毒群序列分析、特异性杂交或克隆分析在内的病毒基因组序列分析。这一现象的临床和生化学意义,尤其是在耐药方面的意义仍不清楚。尽管如此,在人原代肝细胞培养中进行的体外研究和在鸭HBV 模型中进行的体内研究数据均提示,抗病毒治疗中存在病毒血症可导致新细胞感染,并在这些细胞中形成新的cccDNA 分子,从而导致肝脏受感染细胞清除的延迟。
与HIV - 1 感染者在高效抗逆转录病毒治疗中相同,一些HBV 低于检测下限的患者可能会出现短暂的病毒血症。有人认为这一现象提示存在不完全病毒学抑制和/或发生耐药。然而基于HIV 治疗中的经验,多数短暂病毒血症提示患者平均病毒载量低于检测下限,但在生物学和统计学上发生了一定的波动,不太可能提示病毒不完全抑制和/ 或发生耐药。这种短暂的病毒血症与耐药突变无关,也与病毒学或临床治疗失败无关,尤其是在患者接受高耐药屏障药物联合治疗的情况下。
经多种抗病毒药物治疗患者的情况
目前许多患者采用多种抗病毒药物治疗,包括LMV 联合ADV、LMV 和ADV 序贯治疗、甚至再更换为ETV,导致二线或三线治疗药物的选择成为日益显现的问题。而且这种情况下挽救性治疗的效果可能受先前治疗的影响。
在一项欧洲的回顾性多中心研究中,评估了TDF单药治疗对先前各种NA 治疗失败或发生耐药患者的疗效。先前的治疗包括LAM、ADV 和相关序贯及联合治疗。平均治疗23 个月的患者HBV DNA < 400 拷贝/mL(< 60 IU/mL)的总累积比例为79%。LMV 耐药不影响TDF 的疗效,但ADV耐药会影响TDF 的疗效。尽管如此,在整个观察期间患者未出现病毒学突破。
值得注意的是,在一项比较不同治疗对ADV 不完全应答患者疗效的临床试验中,得到的结果与欧洲的研究不同。该研究评估了固定剂量的FTC 和TDF 早期联合(初治联合用药)与TDF 单药治疗的效果。直到治疗24 周(设盲治疗直接比较),两组的病毒水平下降曲线相同。TDF 或TDF 和FTC 复合制剂(Truvada) 治疗48 周时,有81% 的患者HBV DNA 低于检测下限。基线存在LMV或 ADV 相关突变不影响病毒学应答。治疗48 周达到HBV DNA 低于检测下限的主要影响因素是治疗的依从性。相反,近期一项澳大利亚研究分析了对于先前LMV 治疗失败,ADV 治疗至少24 周但病毒仍明显复制的患者(主要为亚裔患者)应用TDF的疗效。治疗48 周和96 周时分别有46% 和64% 的患者HBV DNA 低于检测下限。应答情况与基线LMV 治疗或ADV 耐药无关。然而对一些个案报道的回顾发现,与初治患者相比,基线存在ADV 耐药替换(rtA181Tvs rtN236T ± rtA181T/V)可能影响TDF 治疗的病毒学应答,尤其是对于在基线存在双重突变(rtA181T/V+ rtN236T)的患者(表1),可持续存在较高水平的病毒血症。
对于经各种NA 治疗失败、持续性病毒血症且病情加重的患者,经TDF + FTC(Truvada)联合治疗的临床经验显示该方案抗病毒效果非常好。Kaplan - Meier分析显示联合治疗48 周时HBV DNA 低于检测下限的患者比例为76%,第96 周达94%,无病毒学突破。
重要的是,大多数研究结果显示,TDF 联合LMV 并不比TDF 单药治疗更有效。
欧洲ETV 治疗的临床实践经验显示,只要未出现LMV 耐药(检出rtM204V/I),ETV 对于经LMV 或ADV 治疗患者的病毒抑制效果与在初治患者中相当;不出意外,ADV 耐药不影响ETV 的疗效。有意义的是,ETV 与TDF 的联合治疗已经成功用于因多重耐药治疗失败患者的挽救性治疗。这些结果提示在调整治疗时,应根据治疗史、以往NA 类型和是否存在耐药突变等采用不同的抗病毒策略[ 简单更换为另一种新药或联合两种新药(TDF 或ETV)] 以达到抑制HBV DNA 低于检测下限的目标。

总结
多项临床研究证实,与低耐药屏障药物如LMV、ADV 或LdT 相比,高耐药屏障药物如ETV 和TDF 的耐药率明显较低。一线治疗的正确选择应当包括强效高基因屏障药物,以获得长期持续的抑制病毒复制,从而在最大程度上获得达成首要治疗目标(即防止肝病进展)的机会。大多数患者需要长期接受抗病毒治疗,因此耐药成为主要关注的问题,尤其是在使用低效、低基因屏障药物时。强效、高耐药屏障药物如ETV 或TDF 可以将耐药发生的风险降至最小、维持将来的治疗选择和获得长期治疗成功的最大机会。处理治疗失败的患者需要严格的临床准则和准确的病毒学监测,还需要恰当应用无交叉耐药的互补药物进行早期临床干预(表1)。假如能遵循这些推荐意见,大多数需要抗病毒治疗的CHB患者至少会在中短期内从治疗中受益。对经多种药物序贯治疗的患者,有必要对药物效力和耐药情况进行长期监测。最后,为提高现有抗病毒药物疗效和达到消除HBsAg,甚至期待下一步达到清除HBV 的目的,认识新的治疗目标仍是研究中的主要挑战。
专家点评
上海长海医院 万谟彬教授
经核苷(酸)类似物(NA)治疗患者因耐药导致治疗失败者临床并不少见,对于临床处理我国医生已有一定认识,并积累了较丰富的经验。本文在较全面综述了NA 分类和耐药发生原因并在此基础上提出了治疗失败的处理建议,具有重要参考价值。其中关于治疗失败的主要措施是使用无交叉耐药药物联合疗。这是目前在国际上已经达成的共识,与国际上专业学会的乙型肝炎指南意见基本一致。但其中涉及替诺福韦酯的联合治疗,由于该药在国内尚未面市,并不适合中国国情。国内由于阿德福韦酯价格及来源等因素仍然是联合治疗中的主要药物,其中包括对单药应答不佳或已发生耐药的处理。因此,对于治疗失败的患者仍然建议按照我国慢性乙型肝炎防治指南的推荐建议处理。


































