白细胞介素33在肝细胞癌患者中的表达及其对CD8+T淋巴细胞功能的调节作用
DOI: 10.3969/j.issn.1001-5256.2022.01.018
Expression of interleukin-33 in hepatocellular carcinoma patients and its role in regulating CD8+ T cell function
-
摘要:
目的 观察肝细胞癌(HCC)患者外周血白细胞介素33(IL-33)的变化,探讨IL-33对HCC患者CD8+T淋巴细胞的调节作用和可能机制。 方法 选择2019年4月—2020年1月陕西省人民医院收治的44例HCC患者和20例健康对照者为研究对象。采集外周血,分离血浆和外周血单个核细胞(PBMC),酶联免疫吸附试验检测血浆IL-33及其受体肿瘤抑制素2(ST2)的水平,实时定量PCR法检测PBMC中IL-33和ST2 mRNA相对表达量。纯化CD8+T淋巴细胞,使用重组IL-33刺激培养,CCK-8法检测细胞增殖,酶联斑点吸附试验检测穿孔素和颗粒酶B分泌,流式细胞术检测程序性死亡受体-1(PD-1)、淋巴细胞活化基因-3(LAG-3)和细胞毒性T淋巴细胞相关蛋白4(CTLA-4)表达,比较IL-33刺激前后细胞增殖、毒性分子分泌、免疫检查点分子的变化。CD8+T淋巴细胞与HepG2细胞共培养,通过检测乳酸脱氢酶表达计算CD8+T淋巴细胞诱导HepG2细胞死亡比例,比较IL-33刺激前后CD8+T淋巴细胞杀伤功能的变化。计量资料两组间比较采用t检验或配对t检验,相关性分析采用Pearson分析法。 结果 HCC组血浆IL-33水平低于对照组[(269.80±63.08) pg/mL vs (339.50±64.43) pg/mL,t=4.072,P<0.001],HCC组PBMC中IL-33 mRNA相对表达量低于对照组(1.07±0.14 vs 2.45±0.87,t=10.250,P<0.001)。血浆ST2水平和PBMC中ST2 mRNA相对表达量在HCC组和对照组之间的差异均无统计学意义(P值均>0.05)。CD8+T淋巴细胞比例与血浆IL-33、ST2水平均无明显相关性(P值均>0.05)。HCC组CD8+T淋巴细胞分泌穿孔素、颗粒酶B的水平均低于对照组(P值均<0.05),而HCC组CD8+T淋巴细胞中PD-1、LAG-3、CTLA-4阳性细胞比例均高于对照组(P值均<0.05)。重组IL-33刺激对两组CD8+T淋巴细胞增殖和免疫检查点分子表达均无显著影响(P值均>0.05),但可促进穿孔素、颗粒酶B的分泌(P值均<0.05)。HCC组CD8+T淋巴细胞杀伤活性较对照组降低(P<0.05),重组IL-33刺激可提升CD8+T淋巴细胞杀伤功能,主要表现为诱导HepG2细胞死亡比例升高(P<0.05),IFNγ和TNFα分泌水平增加(P值均<0.05)。 结论 HCC患者血浆IL-33水平降低。IL-33可通过促进穿孔素和颗粒酶B的分泌增强HCC患者CD8+T淋巴细胞杀伤活性,为HCC治疗提供新的靶点。 -
关键词:
- 癌,肝细胞 /
- 白细胞介素33 /
- CD8阳性T淋巴细胞
Abstract:Objective To investigate the change in interleukin-33 (IL-33) in the peripheral blood of hepatocellular carcinoma (HCC) patients and the role and potential mechanism of IL-33 in regulating CD8+ T cell function in HCC patients. Methods A total of 44 HCC patients who attended Shaanxi Provincial People's Hospital from April 2019 to January 2020 and 20 healthy controls were enrolled. Peripheral blood was collected, and plasma and peripheral blood mononucleated cells (PBMCs) were isolated; ELISA was used to measure the plasma levels of IL-33 and its receptor ST2, and quantitative real-time PCR was used to measure the relative mRNA expression levels of IL-33 and ST2 in PBMCs. CD8+ T cells were purified and stimulated with recombinant IL-33; CCK-8 assay was used to assess cell proliferation, enzyme-linked immunospot assay was used to measure the secretion of perforin and granzyme B, and flow cytometry was used to measure the expression of PD-1, LAG-3, and CTLA-4; changes in cell proliferation, secretion of cytotoxic molecules, and immune checkpoint molecules after IL-33 stimulation were compared. CD8+ T cells were co-cultured with HepG2 cells; the expression of lactate dehydrogenase was measured to calculate the proportion of dead HepG2 cells induced by CD8+ T cells, and the change in the killing function of CD8+ T cells after IL-33 stimulation was compared. The t-test or the paired t-test was used for comparison of continuous data between two groups, and a Pearson correlation analysis was performed. Results Compared with the control group, the HCC group had significantly lower plasma level of IL-33 (269.80±63.08 pg/ml vs 339.50±64.43 pg/ml, t=4.072, P < 0.001) and relative mRNA expression level of IL-33 in PBMCs (1.07±0.14 vs 2.45±0.87, t=10.250, P < 0.001). There were no significant differences in the plasma level of ST2 and the relative mRNA expression level of ST2 in PBMCs between the HCC group and the control group (P > 0.05). The proportion of CD8+ T cells was not correlated with the plasma level of IL-33 or ST2 (both P > 0.05). Compared with the control group, the HCC group had significantly lower levels of perforin and granzyme B (both P < 0.05) and a significantly higher proportion of CD8+ T cells with positive PD-1, LAG-3, and CTLA-4 (P < 0.05). Stimulation with recombinant IL-33 did not affect the proliferation of CD8+ T cells or the expression of immune checkpoint molecules (P > 0.05), but it promoted the secretion of perforin and granzyme B (P < 0.05). Compared with the control group, the HCC group had a significant reduction in the killing activity of CD8+ T cells (P < 0.05), and stimulation with recombinant IL-33 enhanced the killing function of CD8+ T cells, which was mainly reflected in the increases in the proportion of dead HepG2 cells (P < 0.05) and the secretion of IFNγ and TNFα (P < 0.05). Conclusion There is a reduction in the plasma level of IL-33 in HCC patients. IL-33 can enhance the killing activity of CD8+ T cells by promoting the secretion of perforin and granzyme B, which provides a new target for the treatment of HCC. -
Key words:
- Carcinoma, Hepatocellular /
- Interleukin-33 /
- CD8-Positive T-Lymphocytes
-
表 1 两组一般资料比较
指标 HCC组
(n=44)对照组
(n=20)统计值 P值 男/女(例) 28/16 13/7 χ2=0.644 0.497 年龄(岁) 49.5±13.4 46.2±11.8 t=0.946 0.348 AFP(ng/mL) 778.1±129.8 5.9±0.7 t=26.489 <0.001 表 2 两组IL-33和ST2水平比较
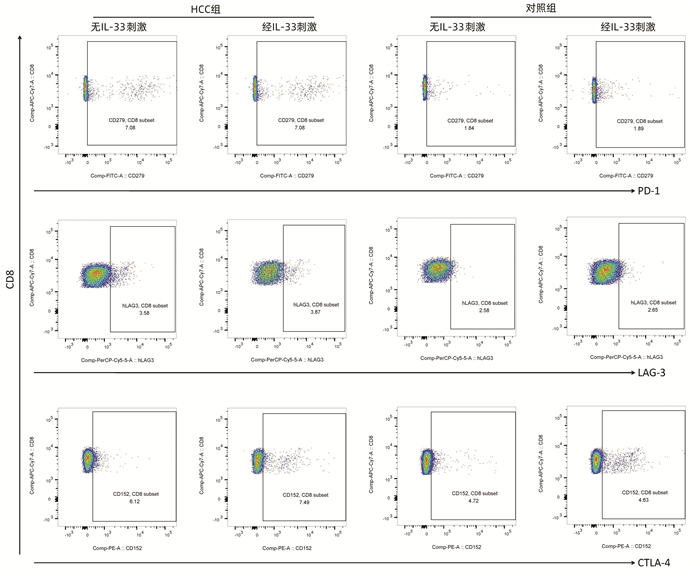
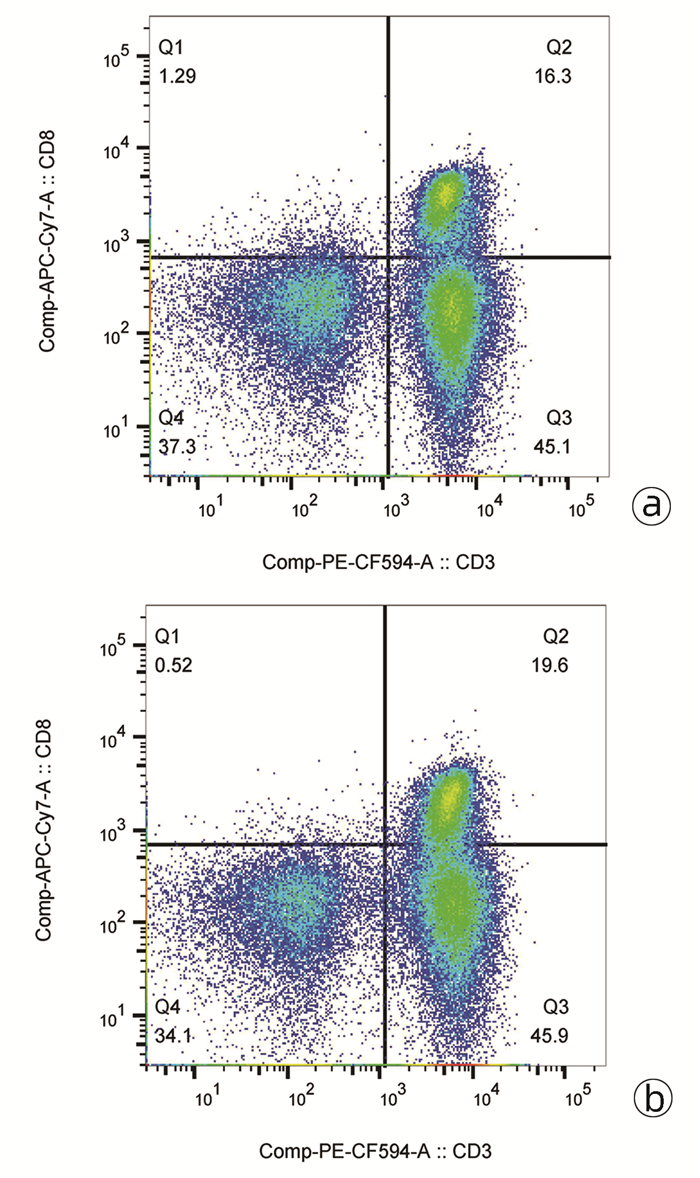
指标 HCC组(n=44) 对照组(n=20) t值 P值 CD3+CD8+T淋巴细胞(%) 27.82±6.97 26.80±10.31 0.468 0.641 血浆IL-33(pg/mL) 269.80±63.08 339.50±64.43 4.072 <0.001 IL-33 mRNA 1.07±0.14 2.45±0.87 10.250 <0.001 血浆ST2(pg/mL) 82.58±10.92 83.50±4.94 0.359 0.721 ST2 mRNA 1.09±0.14 1.07±0.10 0.432 0.667 表 3 两组无IL-33刺激和经IL-33刺激后CD8+T淋巴细胞增殖、毒性分子分泌和免疫检查点分子表达的比较
指标 HCC组(n=28) 对照组(n=11) 无IL-33刺激 经IL-33刺激 t值 P值 无IL-33刺激 经IL-33刺激 t值 P值 细胞增殖(×105个) 1.24±0.08 1.29±0.19 1.077 0.286 1.20±0.13 1.25±0.24 0.581 0.568 穿孔素(×105个) 64.21±9.831) 111.60±36.902) 6.563 <0.001 74.55±8.45 160.90±49.25 5.733 <0.001 颗粒酶B(×105个) 38.82±14.051) 51.32±19.252) 2.775 0.008 92.92±29.44 130.40±46.97 2.436 0.023 PD-1+(%) 7.55±3.531) 7.63±2.922) 0.095 0.925 1.98±0.16 2.17±0.35 1.646 0.116 LAG-3+(%) 3.30±1.011) 3.63±1.072) 1.207 0.233 2.51±0.64 2.82±0.65 1.140 0.268 CTLA-4+(%) 7.85±1.001) 7.86±0.732) 0.014 0.989 4.15±1.13 4.86±0.97 1.600 0.125 注:与对照组无IL-33刺激比较,1) P<0.05;与对照组经IL-33刺激比较,2)P<0.05。 表 4 无IL-33刺激和经IL-33刺激后CD8+T淋巴细胞杀伤功能比较
指标 HCC组(n=11) 对照组(n=6) 无IL-33刺激 经IL-33刺激 t值 P值 无IL-33刺激 经IL-33刺激 t值 P值 细胞死亡比例(%) 14.90±4.27 20.86±3.73 3.482 0.002 21.97±5.72 30.30±4.24 2.866 0.017 IFNγ (pg/mL) 29.27±6.081) 38.36±9.752) 2.624 0.016 38.33±10.09 56.00±7.18 3.493 0.006 TNFα (pg/mL) 807.8±130.51) 1276±368.22) 3.978 <0.001 1147±264.0 2200±706.2 3.421 0.007 注:与对照组无IL-33刺激比较,1) P<0.05;与对照组经IL-33刺激比较,2)P<0.05。 -
[1] CHEN Y, TIAN Z. HBV-induced immune imbalance in the development of HCC[J]. Front Immunol, 2019, 10: 2048. DOI: 10.3389/fimmu.2019.02048. [2] HOFMANN M, TAUBER C, HENSEL N, et al. CD8+ T cell responses during HCV infection and HCC[J]. J Clin Med, 2021, 10(5): 991. DOI: 10.3390/jcm10050991. [3] CAYROL C, GIRARD JP. Interleukin-33?(IL-33): A nuclear cytokine from the IL-1 family[J]. Immunol Rev, 2018, 281(1): 154-168. DOI: 10.1111/imr.12619. [4] JIN Z, LEI L, LIN D, et al. IL-33 released in the liver inhibits tumor growth via promotion of CD4(+) and CD8(+) T cell responses in hepatocellular carcinoma[J]. J Immunol, 2018, 201(12): 3770-3779. DOI: 10.4049/jimmunol.1800627. [5] LI A, HERBST RH, CANNER D, et al. IL-33 signaling alters regulatory T cell diversity in support of tumor development[J]. Cell Rep, 2019, 29(10): 2998-3008. e8. DOI: 10.1016/j.celrep.2019.10.120. [6] Bureau of Medical Administrationnational Health Commission of The People's Republic of China. Guidelines for diagnosis and treatment of primary liver cancer in China (2019 edition)[J]. J Clin Hepatol, 2020, 36(2): 277-292. DOI: 10.3969/j.issn.1001-5256.2020.02.007.中华人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗规范(2019年版)[J]. 临床肝胆病杂志, 2020, 36(2): 277-292. DOI: 10.3969/j.issn.1001-5256.2020.02.007. [7] BOEGEL S, LÖWER M, BUKUR T, et al. A catalog of HLA type, HLA expression, and neo-epitope candidates in human cancer cell lines[J]. Oncoimmunology, 2014, 3(8): e954893. DOI: 10.4161/21624011.2014.954893. [8] LI PP, ZHANG XM, YUAN D, et al. Decreased expression of IL-33 in immune thrombocytopenia[J]. Int Immunopharmacol, 2015, 28(1): 420-424. DOI: 10.1016/j.intimp.2015.06.035. [9] XU H, TURNQUIST HR, HOFFMAN R, et al. Role of the IL-33-ST2 axis in sepsis[J]. Mil Med Res, 2017, 4: 3. DOI: 10.1186/s40779-017-0115-8. [10] LU Y. Correlation of serum interleukin-33 with HBV DNA load and ALT level in patients with chronic hepatitis B[J]. J Clin Hepatol, 2015, 31(11): 1853-1856. DOI: 10.3969/j.issn.1001-5256.2015.11.020.陆盈. 慢性乙型肝炎患者血清白细胞介素33与HBV DNA及ALT水平的相关性分析[J]. 临床肝胆病杂志, 2015, 31(11): 1853-1856. DOI: 10.3969/j.issn.1001-5256.2015.11.020. [11] ANTUNES MM, ARAÚJO AM, DINIZ AB, et al. IL-33 signalling in liver immune cells enhances drug-induced liver injury and inflammation[J]. Inflamm Res, 2018, 67(1): 77-88. DOI: 10.1007/s00011-017-1098-3. [12] YAZDANI HO, CHEN HW, TOHME S, et al. IL-33 exacerbates liver sterile inflammation by amplifying neutrophil extracellular trap formation[J]. J Hepatol, 2017. DOI: 10.1016/j.jhep.2017.09.010.[Onlineaheadofprint] [13] DU XX, SHI Y, YANG Y, et al. DAMP molecular IL-33 augments monocytic inflammatory storm in hepatitis B-precipitated acute-on-chronic liver failure[J]. Liver Int, 2018, 38(2): 229-238. DOI: 10.1111/liv.13503. [14] KHAN HA, MUNIR T, KHAN JA, et al. IL-33 ameliorates liver injury and inflammation in Poly Ⅰ∶ C and Concanavalin-A induced acute hepatitis[J]. Microb Pathog, 2021, 150: 104716. DOI: 10.1016/j.micpath.2020.104716. [15] YANG Y, WANG JB, LI YM, et al. Role of IL-33 expression in oncogenesis and development of human hepatocellular carcinoma[J]. Oncol Lett, 2016, 12(1): 429-436. DOI: 10.3892/ol.2016.4622. [16] PENG C, HAN J, YE X, et al. IL-33 Treatment attenuates the systemic inflammation reaction in acinetobacter baumannii pneumonia by suppressing TLR4/NF-κB signaling[J]. Inflammation, 2018, 41(3): 870-877. DOI: 10.1007/s10753-018-0741-7. [17] LV R, ZHAO J, LEI M, et al. IL-33 Attenuates sepsis by inhibiting IL-17 receptor signaling through upregulation of SOCS3[J]. Cell Physiol Biochem, 2017, 42(5): 1961-1972. DOI: 10.1159/000479836. [18] BAO Q, LV R, LEI M. IL-33 attenuates mortality by promoting IFN-γ production in sepsis[J]. Inflamm Res, 2018, 67(6): 531-538. DOI: 10.1007/s00011-018-1144-9. [19] ALVES-FILHO JC, SȎNEGO F, SOUTO FO, et al. Interleukin-33 attenuates sepsis by enhancing neutrophil influx to the site of infection[J]. Nat Med, 2010, 16(6): 708-712. DOI: 10.1038/nm.2156. [20] NASCIMENTO DC, MELO PH, PIÑEROS AR, et al. IL-33 contributes to sepsis-induced long-term immunosuppression by expanding the regulatory T cell population[J]. Nat Commun, 2017, 8: 14919. DOI: 10.1038/ncomms14919. [21] XIA Y, OHNO T, NISHⅡ N, et al. Endogenous IL-33 exerts CD8(+) T cell antitumor responses overcoming pro-tumor effects by regulatory T cells in a colon carcinoma model[J]. Biochem Biophys Res Commun, 2019, 518(2): 331-336. DOI: 10.1016/j.bbrc.2019.08.058. [22] DREIS C, OTTENLINGER FM, PUTYRSKI M, et al. Tissue cytokine IL-33 modulates the cytotoxi CD8 T lymphocyte activity during nutrient deprivation by regulation of lineage-specific differentiation programs[J]. Front Immunol, 2019, 10: 1698. DOI: 10.3389/fimmu.2019.01698. [23] ROOD JE, BURN TN, NEAL V, et al. Disruption of IL-33 signaling limits early CD8+ T cell effector function leading to exhaustion in murine hemophagocytic lymphohistiocytosis[J]. Front Immunol, 2018, 9: 2642. DOI: 10.3389/fimmu.2018.02642. [24] WANG W, WU J, JI M, et al. Exogenous interleukin-33 promotes hepatocellular carcinoma growth by remodelling the tumour microenvironment[J]. J Transl Med, 2020, 18(1): 477. DOI: 10.1186/s12967-020-02661-w. [25] ZHAO R, YU Z, LI M, et al. Interleukin-33/ST2 signaling promotes hepatocellular carcinoma cell stemness expansion through activating c-Jun N-terminal kinase pathway[J]. Am J Med Sci, 2019, 358(4): 279-288. DOI: 10.1016/j.amjms.2019.07.008. -


 PDF下载 ( 3969 KB)
PDF下载 ( 3969 KB)

 下载:
下载: